Vor allem organische Chemiker*innen untersuchten das chemische Verhalten von Amiden und entwickelten eine Vielfalt an Methoden, um sie nach Belieben zu verändern. Nuno Maulide, Institutsvorstand der Organischen Chemie, hat seit jeher großes Interesse an einer Unterart solcher Methoden, der sogenannten elektrophilen Amidaktivierung.
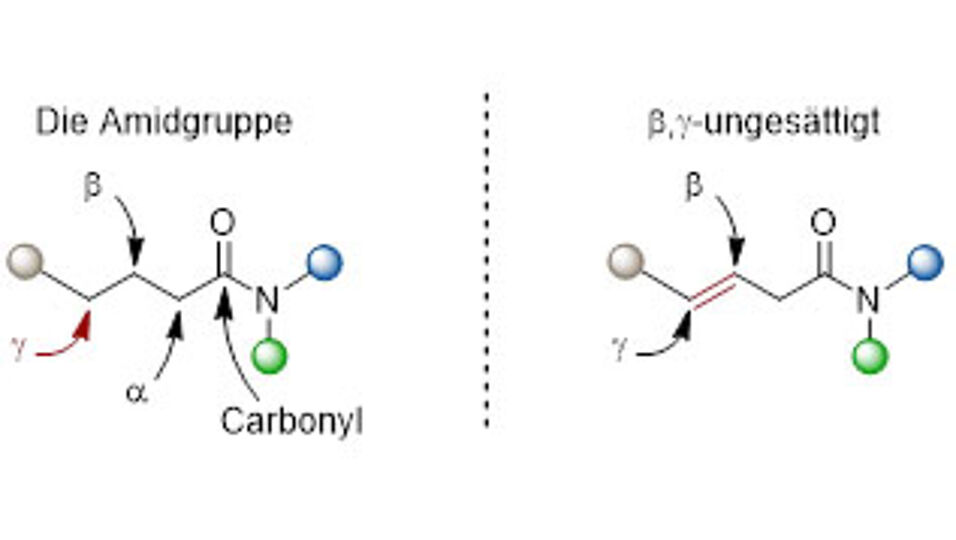
Die Carbonyl- sowie die a- und b-Positionen von Amiden können inzwischen mit einer Vielzahl an Methoden modifiziert werden. Für die vierte, die g-Position, gab es allerdings bis zuletzt noch keine Möglichkeit zur Funktionalisierung durch elektrophile Amidaktivierung.
Unter der Betreuung von Nuno Maulide hat nun der Masterstudent Sebastian Heindl gemeinsam mit seinen Kolleg*innen Margaux Riomet, Ján Matyasovsky, Miran Lemmerer und Nicolas Malzer eine neue Synthesemethode entwickelt, um diese Position selektiv, also ohne unerwünschte Nebenreaktionen, zu modifizieren.
Hohe Selektivität
Die hohen Produktausbeuten verhindern dabei die Erzeugung großer Mengen Abfall. Um diese Spezifizität zu erreichen, verwenden die Forscher*innen b,g-ungesättigte Amide, also Moleküle die eine C–C Doppelbindung zwischen den Positionen b und g enthalten.
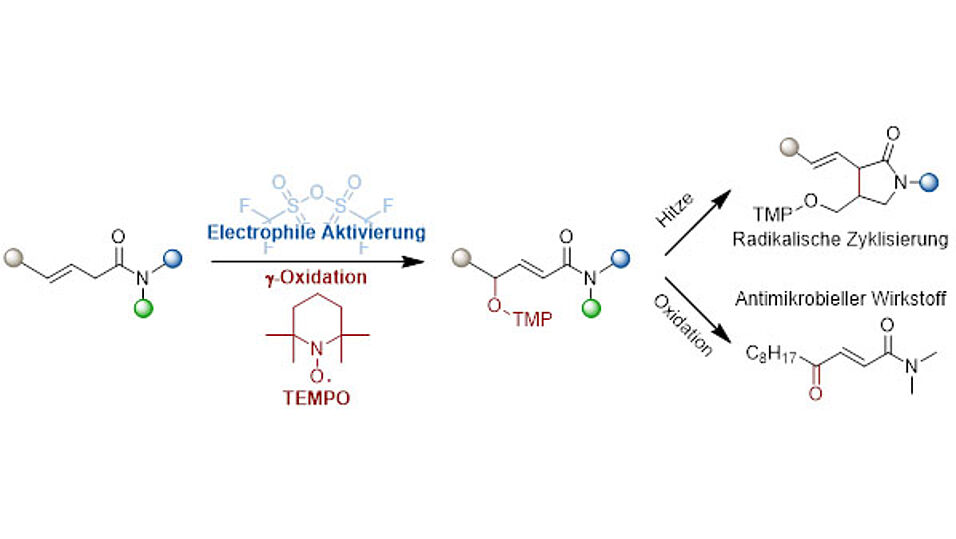
Im Rahmen der vorgestellten Methode wurde das Amid mithilfe des Reagenzes Trifluormethansulfonsäureanhydrid aktiviert, sodass das stabile Radikal TEMPO zur Reaktion gebracht wurde und ein g-oxaminiertes Amid entstand. Die einfache Handhabung erlaubte den Forscher*innen, eine Fülle an Molekülen herzustellen und sie auf ihr chemisches Verhalten zu untersuchen. Bisher war nur wenig über eben dieses Verhalten bekannt, unter anderem weil es keine einfache Methode zur Herstellung solcher Amide gab.
Erstaunlicherweise konnten die erzeugten Stoffe durch Erhitzen in sogenannte g-Lactame überführt werden. Diese Reaktion, als radikalische Zyklisierung bezeichnet, stellte sich als besonders selektiv heraus. Zusätzlich verbanden die Forscher*innen die neue Methode mit einer Oxidationsreaktion, wodurch sie antimikrobielle Wirkstoffe erzeugen konnten. Die Forschungsarbeit wurde unlängst im international renommierten Journal "Angewandte Chemie" veröffentlicht.
Publikation in Angewandte Chemie International Edition:
Heindl, S.; Riomet, M.; Matyasovsky, J.; Lemmerer, M.; Malzer N.; Maulide N. Chemoselective g-Oxidation of b,g-Unsaturated Amides with TEMPO, Angew. Chem. Int. Ed. 2021, DOI: 10.1002/anie.202104023