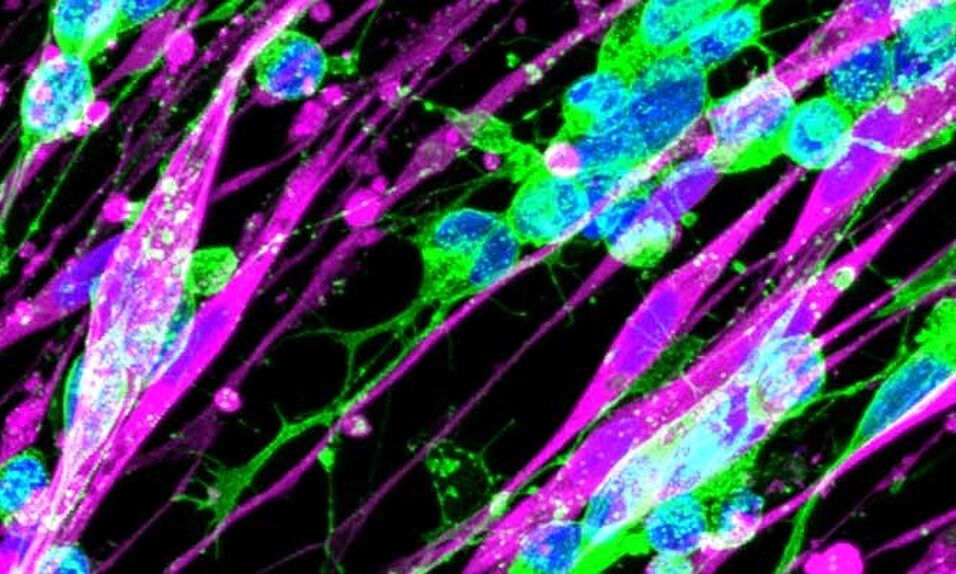
Was auf den ersten Blick widersprüchlich klingt, nämlich einen Tumor mit einem Wachstumsfaktor zu befeuern, macht beim Neuroblastom Sinn. Dieser im Kindesalter am häufigsten vorkommende solide Tumor besteht nämlich aus unreifen Nervenzellen, die sich unkontrolliert vermehren. Im Gegensatz zu bösartigen Neuroblastomen sind in gutartigen viele "Schwann-Zellen" vorhanden, also jene Zellen, die Nervenzellen normalerweise schützen und reparieren können. Die Ergebnisse der nun publizierten Studie legen nahe, dass die Schwann-Zellen im Neuroblastom die Tumorzellen zur Reifung anregen und damit ihr ungebremstes Wachstum zum Stillstand bringen.
Eine Zelle, die das Tumorwachstum stoppt …
Um das zu bewerkstelligen, produzieren Schwann-Zellen unter anderem ein Signalmolekül namens Epidermal Growth Factor Like 8 (EGFL8). Das Forschungsteam konnte nachweisen, dass EGFL8 die Ausdifferenzierung, also Reifung der Neuroblastom-Zellen anregt. "Bisher wusste man zwar, dass es dieses Protein gibt, aber man kannte seine Funktion nicht. Wir haben diese nun erstmals beschrieben", erklärt Studienautorin Sabine Taschner-Mandl, Leiterin der Gruppe Tumorbiologie der St. Anna Kinderkrebsforschung. Weiters zeigen die Ergebnisse, dass eine hohe EGFL8-Expression, also die Umsetzung der Erbinformation in ein Eiweißmolekül, bei Neuroblastomen mit längerem Überleben von Patientinnen und Patienten einherging.
"In Zellkulturen haben wir nachgewiesen, dass Schwann-Zellen und die von ihnen freigesetzten Signalmoleküle ihre Anti-Tumor-Wirkung auch bei aggressiven Neuroblastomen entfalten. Wir können somit einen in gutartigen Neuroblastomen natürlich ablaufenden Prozess nutzen, um die bösartigen zu stoppen", erklären Taschner-Mandl und ihre Kollegin Tamara Weiss von der Medizinischen Universität Wien. Neben EGFL8 könnten auch andere, bisher noch nicht charakterisierte Schwann-Zell-Moleküle, Ansatzpunkte für Krebstherapien bieten.
Die Effekte der Schwann-Zellen sind aber wahrscheinlich noch viel weitreichender: Das Forschungsteam untersucht zurzeit wie Schwann-Zellen Abwehrzellen in ihrer Umgebung manipulieren.
… und die Heilung verletzter Nervenfasern fördert
Die vorliegende Studie liefert noch eine weitere wesentliche Erkenntnis: Die Schwann-Zellen in gutartigen Neuroblastomen weisen einen ähnlichen zellulären Status auf, wie jene Schwann-Zellen, die die Heilung verletzter peripherer Nerven unterstützen. Erst der direkte Vergleich hat gezeigt, dass die Schwann-Zellen im Tumor die Expression bestimmter Reparatur-assoziierter Gene sowie spezifische Reparaturfunktionen aufweisen. "Es ist erstaunlich, dass wir dadurch ein Signalmolekül entdeckt haben, das sowohl in der Tumorentwicklung gutartiger Neuroblastome als auch in der Regeneration verletzter Nerven eine Rolle spielt. Da EGFL8 die Bildung von Nervenzellfortsätzen stimuliert, könnte es für die Behandlung von verletzten Nervenfasern von großer Bedeutung sein", sagt Weiss.
Diese Studie beweist eindrucksvoll die Leistungsfähigkeit der Kombination von relevanten Krankheitsmodellen mit Massenspektrometrie-basierten Screening-Methoden, welche von der Fakultät für Chemie der Universität Wien durchgeführt wurden. "Schon in einer gemeinsam publizierten Vorstudie konnten einige vielversprechende Kandidatenmoleküle identifiziert werden, die in der aktuellen Studie auf ihre Wirksamkeit überprüft und mit ganz neu entwickelten zeitaufgelösten Phospho-Proteom-Analyseverfahren in Bezug auf ihre unmittelbaren Zelleffekte erfolgreich charakterisiert werden konnten", sagt Christopher Gerner vom Institut für Analytische Chemie und Leiter der Joint Metabolome Facility der Uni Wien und der MedUni Wien.
Aussicht auf Anwendung bei aggressiven Tumoren
Denkbar ist, EGFL8 und andere Faktoren, die von Schwann-Zellen gebildet werden, in der Behandlung von Nervenschäden sowie von aggressiven Neuroblastomen einzusetzen. "Mittels der Phosphoproteomics-Methode konnten wir entschlüsseln, welche Signalwege in Neuroblastom-Zellen durch EGFL8 angeschaltet werden. Es gibt große Unterschiede im Vergleich zu Zellen, die nicht mit EGFL8 stimuliert wurden", so Taschner-Mandl. Neben EGFL8 stellen auch diese nachgeschalteten Signalwege mögliche Angriffspunkte für zukünftige Behandlungsmethoden dar. "Bis diese Erkenntnisse letztendlich bei der Patientin bzw. dem Patienten ankommen, ist es noch ein weiter Weg. Aber wir haben jetzt einmal die Grundlagen dafür geschaffen."
Publikation
Schwann cell plasticity regulates neuroblastic tumor cell differentiation via epidermal growth factor like protein 8: Tamara Weiss, Sabine Taschner-Mandl, Lukas Janker, Andrea Bileck, Fikret Rifatbegovic, Florian Kromp, Helena Sorger, Maximilian O. Kauer, Christian Frech, Reinhard Windhager, Christopher Gerner, Peter F. Ambros, Inge M Ambros, Nature Communications, 12. März 2021, DOI: 10.1038/s41467-021-21859-0, http://www.nature.com/ncomms
Förderung
Diese Studie wurde unterstützt durch Förderungen der Österreichischen Forschungsförderungsgesellschaft (FFG), sowie durch das European Union’s Seventh Framework Program (FP7/2007–2013) im Rahmen der Projekte European Network for Cancer Research in Children and Adolescents (ENCCA; HEALTH-F2-2011-261474) und
Targeted Modulation of Immune-System Responses in Cell Therapies (MODICELL; FP7-PEOPLE-2011-IAPP). Weitere Unterstützung erfolgte durch die Herzfeldersche Familienstiftung und die St. Anna Kinderkrebsforschung.
Über die St. Anna Kinderkrebsforschung
Die St. Anna Kinderkrebsforschung (St. Anna Children’s Cancer Research Institute, CCRI) ist eine internationale und interdisziplinäre Forschungseinrichtung, die das Ziel verfolgt, durch innovative Forschung diagnostische, prognostische und therapeutische Strategien für die Behandlung von an Krebs erkrankten Kindern und Jugendlichen weiterzuentwickeln und zu verbessern. Unter Einbeziehung der spezifischen Besonderheiten kindlicher Tumorerkrankungen arbeiten engagierte Forschungsgruppen auf den Gebieten Tumorgenomik und -epigenomik, Immunologie, Molekularbiologie, Zellbiologie, Bioinformatik und klinische Forschung gemeinsam daran, neueste wissenschaftlich-experimentelle Erkenntnisse mit den klinischen Bedürfnissen der Ärztinnen und Ärzte in Einklang zu bringen und das Wohlergehen der jungen Patientinnen und Patienten nachhaltig zu verbessern.
Weitere Informationen: www.kinderkrebsforschung.at, www.ccri.at
Über die Medizinische Universität Wien
Die Medizinische Universität Wien ist eine der traditionsreichsten medizinischen Ausbildungs- und Forschungsstätten Europas. Mit rund 8.000 Studierenden ist sie heute die größte medizinische Ausbildungsstätte im deutschsprachigen Raum. Mit 5.500 Mitarbeiterinnen und Mitarbeitern, 30 Universitätskliniken und zwei klinischen Instituten, zwölf medizintheoretischen Zentren und zahlreichen hochspezialisierten Laboratorien zählt sie auch zu den bedeutendsten Spitzenforschungsinstitutionen Europas im biomedizinischen Bereich.
Weitere Informationen: www.meduniwien.ac.at
Über die Universität Wien
Die Universität Wien schafft vielfältige Impulse. Im Bereich der Forschung kooperiert sie mit Wirtschaft, Kultur und Gesellschaft. Ihre Lehre bereitet die jährlich rund 10.000 Absolventinnen und Absolventen auf ihre Berufslaufbahn vor und regt sie zu kritischem Denken und selbstbestimmtem Handeln an.
Die Universität Wien ist eine der ältesten und größten Universitäten Europas: An 20 Fakultäten und Zentren arbeiten rund 9.900 Mitarbeiterinnen und Mitarbeitern, davon 6.900 Wissenschafterinnen und Wissenschaftler. Die Universität Wien ist damit die größte Forschungsinstitution Österreichs sowie die größte Bildungsstätte: Derzeit sind rund 89.000 nationale und internationale Studierende inskribiert; mit 178 Studien verfügt sie über das vielfältigste Studienangebot des Landes. Die Universität Wien ist auch eine bedeutende Einrichtung für Weiterbildung. www.univie.ac.at