"Mein größter Wunsch ist es natürlich, dass unsere Radiopharmazeutika einmal den Weg in die Klinik finden und somit Patient*innen zugute kommen", sagt Thomas Mindt, der derzeit eine Arbeitsgruppe am Institut für Anorganische Chemie aufbaut. Ob dies gelingt, hängt von vielen Faktoren ab. Seine Entwicklungsarbeit ähnle der mehrstufigen Entwicklung eines neuen Medikamentes, so der Chemiker.
Über die chemische Synthese stellt der Forscher neuartige Vorläufermoleküle für die Radiomarkierung her oder nutzt bereits bekannte Biomarker für onkologische Fragestellungen, die dann über eine neu zu entwickelnde Methodik mit radioaktiven Isotopen markiert werden können.
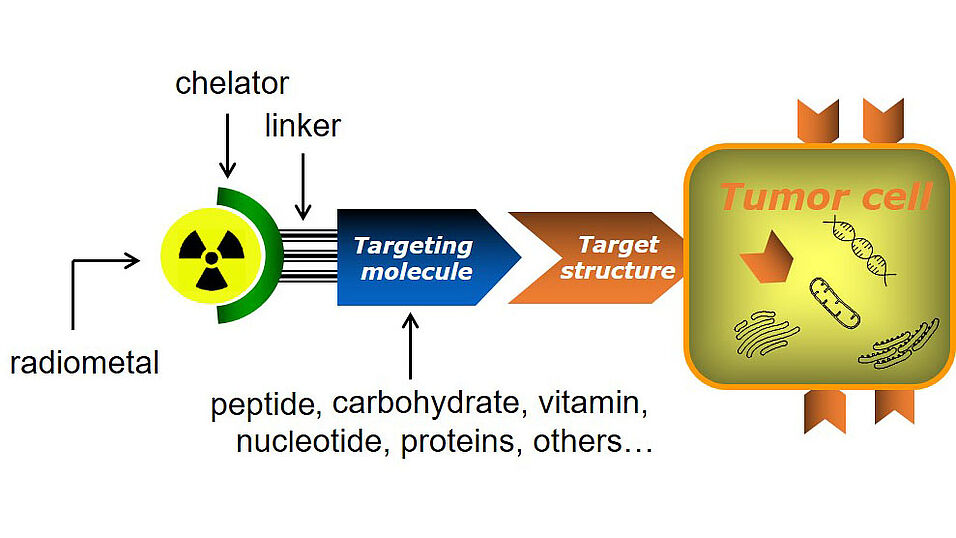
Die Verbindungen – bestehend aus dem spezifischen Isotop, dem Tumor-spezifischen Biomolekül wie auch einem häufig ebenfalls noch zu entwickelnden Chelator für die koordinative Bindung des Radiometalls – quasi der Klebstoff zwischen Radionuklid und Molekül – wird dann erst in-vitro an Zellen und bei Erfolg im Tiermodell getestet, bevor weitere Schritte in Richtung klinischer Studien (z.B. toxikologische Studien) folgen können.
Radiopharmazeutika finden nicht nur bei der Diagnose und Therapie von Krebs, sondern etwa auch in der Kardiologie und bei Hirnfunktions-Untersuchungen Anwendung.
Zielgerichteter Transport zum Tumor
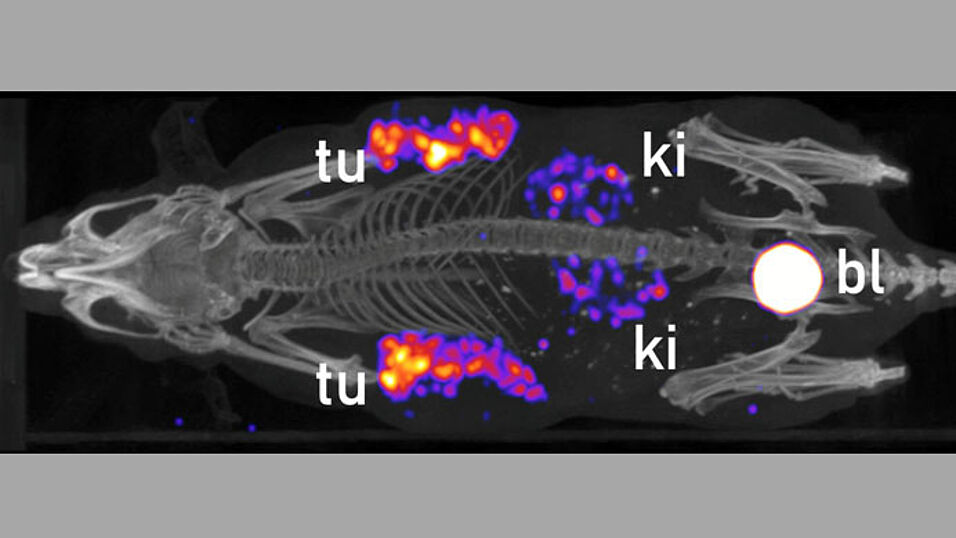
Nach der intravenösen Injektion können sich die radioaktiv markierten Wirkstoffe im ganzen Körper verbreiten und spüren zielgerichtet auch kleinere Metastasen auf: "Denn hier gilt das Schlüssel-Schloss-Prinzip: Der Tumor ist quasi das Schloss, auf das unser radioaktiv markierter Wirkstoff wie ein Schlüssel passt."
"Viele Biomarker, die man zur Ansprache bei Krebserkrankungen verwenden kann, sind bereits gut bekannt und versprechen einen zielgerichteten Transport der Radioaktivität zum Tumor", so der Forscher. Doch auch die Entwicklung von neuen Biomarkern ist Bestandteil seiner Forschung.
Nach Verbindung mit einem Radionuklid darf das Molekül aber auch nicht seine Funktion verlieren oder seine Eigenschaften fürs Zusammenspiel von Wirkstoff und Körper ändern, also die Pharmakokinetik und -dynamik beeinflussen: "Die Radioaktivität soll ja nur dort ankommen, wo der Tumor ist und sonst nirgendwo."
Vergleichsweise geringe Strahlungswerte
Die Identifizierung und Lokalisierung von Tumoren und Metastasen erfolgt über bildgebende Verfahren der Nuklearmedizin, etwa die Positronen-Emissions-Tomographie (PET) und Einzelphotonen-Emissions-Computertomografie (SPECT). Mit ihnen lässt sich auch messen, wie fortgeschritten eine Erkrankung ist und wie Patient oder Patientin auf eine Therapie ansprechen.
Mit einem anderen passenden Radionuklid ausgestattet, können die Biomoleküle auch der Behandlung durch interne Bestrahlung dienen. Mindt ergänzt: "Im Vergleich zur externen Strahlentherapie kann die systemische Applikation von radioaktiv markierten Wirkstoffen wirklich gezielt und unabhängig vom Verbreitungsgrad bestehende Metastasen vernichten und damit auch einer erneuten Erkrankung vorbeugen." Auf die Erkrankung Betroffener abgestimmte Radiopharmazeutika bieten zudem Möglichkeiten, die Diagnostik und Therapie, kurz Theranostik, möglichst personalisiert auszurichten und unnötige Belastungen zu vermeiden.
Die Halbwertszeiten klinisch relevanter Isotope können sehr stark variieren: Die Isotope 13N (Stickstoff-13) und 11C (Kohlenstoff-11) sind in der Medizin besonders kurzlebige Isotope mit Halbwertszeit von nur ein paar Minuten. "Bei unseren Metall-basierenden Radiopharmazeutika sind Halbwertszeiten von ein paar Stunden bis ein paar Tagen üblich", so der Forscher.
Exotische metallische Radionuklide
Es gibt bereits etablierte Radiopharmazeutika, etwa gegen Schilddrüsenkrebs (z.B. Radiojodtherapie). Jüngere Neuzulassungen beziehen sich auf neuroendokrine Tumore und Prostatakrebs. Thomas Mindt konzentriert sich vor allem auf Darm- und Prostatakrebs, jüngst auch Blasen- und Brustkrebs. Dabei interessieren ihn vor allem "exotische, noch nicht etablierte" metallische Radioisotope wie z.B. Zirkonium-89, Scandium-44 oder Actinium-225.
Ein Metall ist relativ einfach durch ein anderes Metall zu ersetzen – so kommt man schnell zu theranostischen Anwendungen, die derzeit in der Onkologie sehr gefragt sind.
Mindts Tenure-Track Professur für Radiochemie, angesiedelt in der Fakultät für Chemie, dient auch als Brückenschlag zur Medizinische Universität Wien. Den Brückenschlag repräsentiert auch das interuniversitäre Wiener Ludwig Boltzmann Institut Angewandte Diagnostik, welches Thomas Mindt vor rund fünf Jahren mitbegründete und welches für ihn nach wie vor ein wichtiger Partner ist.
Ass.-Prof. Dr. Thomas Mindt, Privatdoz. hat seit Oktober 2020 die Tenure Track-Professur Radiochemie am Institut für Anorganische Chemie der Universität Wien inne. Er studierte Organische Chemie und Biotechnologie in der Schweiz, promovierte in organischer Chemie an der Brown University, USA, und arbeitete als Oberassistent im Bereich Radiopharmazeutische Wissenschaften an der ETH in Zürich. Nach einer Assistenz- und Honorarprofessur an der Universität Basel wechselte er 2016 als Mitbegründer des Ludwig Boltzmann Institutes für Angewandte Diagnostik nach Wien und leitete dort die Abteilung Imaging Biomarkers.