Ein erwachsener Mensch besteht aus geschätzten 10 Billionen Zellen, eine Zelle aus ähnlich vielen Atomen. Zudem gibt es ungefähr 500 histologisch eindeutige Zelltypen, die verschiedene Funktionen ausüben und sich gegenseitig beeinflussen können: "In diesem Umfeld der Komplexität versuchen wir, die molekulare Wirkungsweise von Wirkstoffkandidaten genauer zu verstehen und Erkrankungsvorgänge gezielt zu beeinflussen", sagt Samuel Meier-Menches. Von den neuen Erkentnissen können Diagnose und Therapie, besonders im Zuge der Präzisionsmedizin, profitieren.
In der postgenomischen Ära
Mit seiner Tenure Track-Stelle ist der Chemiker an der Joint Metabolome Facility der Fakultät für Chemie angesiedelt. Diese wird gemeinsam mit der Medizinischen Universität Wien betrieben. Die Forscher*innen nutzen hier modernste massenspektrometrische Verfahren und postgenomische Analysestrategien, um zu untersuchen, wie Protein- und Stoffwechselhaushalt im Fall von Erkrankungen und bei Therapien wechselwirken.
"Aus der Grundlagenforschung kommend ist für mich die Nähe zur Klinik äußerst spannend. Wir designen Experimente für unsere Hypothesen, die wir wiederum unter Nutzung von klinischem Probenmaterial testen können. Der Austausch mit Mediziner*innen öffnet dabei auch persönlich neue Horizonte im Verständnis von Erkrankungen", so der Chemiker: "In dieser Forschungsumgebung geht es um den effizienten Brückenschlag zwischen Chemie, Biologie und Medizin, von dem alle Seiten profitieren können." Die Chemie könne hier neuartige und umfassende Methoden liefern, die das Grundverständnis über molekulare Wechselwirkungen erweitern.
Wie neuartige Wirkstoffkandidaten wirken, ist nicht immer leicht zu beantworten.
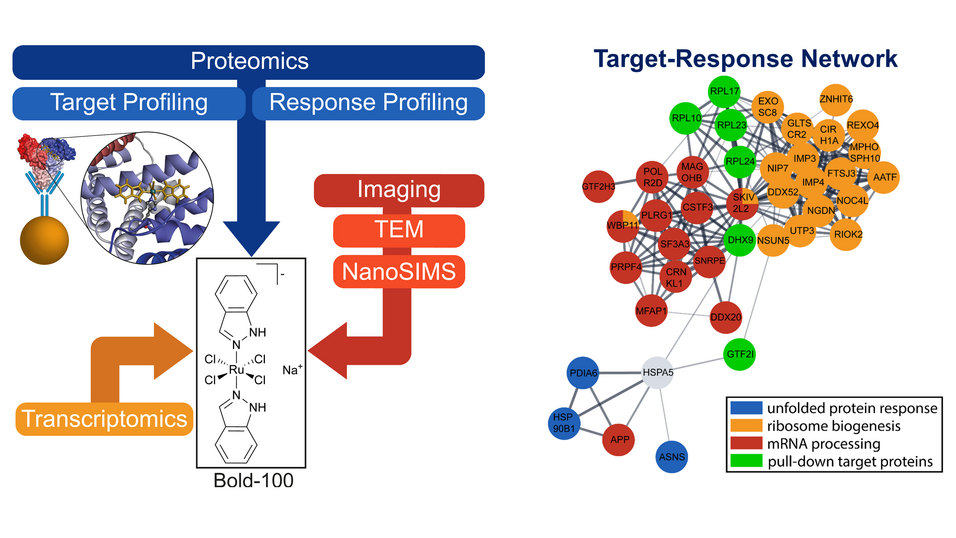
In einer kürzlich publizierten Studie konnte Samuel Meier-Menches mit Kolleg*innen einen Teil des Wirkmechanismus von BOLD-100, einem rutheniumhaltigen Wirkstoffkandidat gegen verschiedene Krebserkrankungen, aufdecken. Das wiederum könnte dazu dienen, BOLD-100 als tumorhemmenden Wirkstoff gezielter einzusetzen. "Es gibt immer mehr substanzielle Hinweise darauf, welche Effekte dieser Wirkstoffkandidat in Krebszellen auslöst – das kann man pharmakologisch ausnutzen."
Alternative Wege im Wirkstoffdesign
Der Chemiker interessiert sich nicht nur für klassische Krebstherapien mit Zytostatika, die die Krebszellen bekämpfen. Er widmet sich auch Ansätzen, wie man Krebs tatsächlich heilen kann: So untersucht er mit seiner Gruppe derzeit, wie es bei akuter Promyelozytenleukämie (einer seltenen Form der Akuten Myeloischen Leukämie) mit Arsentrioxid in einer Kombinationstherapie gelingt, die Krebszellen "umzupolen". Denn die befallenen Zellen erlangen im Zuge dieser Therapie ihre eigentliche Funktion wieder und können sich normal in Neutrophile (weiße Blutkörperchen) weiterentwickeln. Diese bereits zugelassene Behandlungsform besser zu verstehen, habe "enormes Potenzial für die Krebstherapie", so Meier-Menches.
Der War on Cancer wurde vor 50 Jahren von US-Präsident Robert Nixon ausgerufen – ich bin manchmal ernüchtert, wie wenig wir nach wie vor in den Händen halten, um Krebs dauerhaft zu heilen.
Samuel Meier-Menches, Joint Metabolome Facility
Erweiterung des Wissens
Die Komplexität des menschlichen Organismus und der molekularen Vorgänge ist für den Chemiker eine große Antriebskraft, an der Grenze des Wissens zu forschen - und zwar interdisziplinär: Eine große Herausforderung ist dabei, "eine gemeinsame Sprache zwischen den Disziplinen zu finden, um das Wissen zu erweitern, damit schlussendlich Patient*innen von neuen Erkenntnissen in der Grundlagenforschung profitieren können", meint Meier-Menches: "Postgenomische Analyseverfahren in der Präzisionsmedizin schaffen hier optimale Rahmenbedingungen für wissenschaftlichen Fortschritt."
Ass.-Prof. Dr. Samuel Matthias Meier-Menches, Privatdoz. arbeitet am Institut für Analytische Chemie, am Institut für Anorganische Chemie und an der Joint Metabolome Facility. Mit 1. April 2021 hat er die Tenure Track-Stelle Translationale Präzisionsanalytik in der individualisierten Medizin übernommen. https://www.jmef.univie.ac.at/ und https://anchem.univie.ac.at/